挑战与机遇并存的双特异性抗体 | 分享·研报
本文将告诉您:
1.双特异性抗体研发现状如何?
2.双抗的未来疗法有什么样的特点?
3.双特异性抗体面临哪些亟待解决的主要挑战,又将拥有什么样的爆发式发展机遇?
一、双特异性抗体简介
双特异性抗体(BsAb)又称双功能抗体(简称“双抗”),由两个不同的结合结构域组成,能够结合两种不同的抗原或同一抗原的两个不同表位发挥其作用。[1, 2]
由于疾病(尤其是肿瘤)的复杂性,基于靶向两个疾病抗原的抗体联合应用时带来的较好协同效应,期望通过双抗独特的作用机制带来“1+1>2”的效果,并且能够优化给药方案,激发了人们对于“双抗”研究的热衷。从国外到国内的生物药研发公司纷纷在布局双抗项目,既有自主知识产权的双抗技术平台的研发,也有基于他人技术平台进行的药物开发。近年来双抗已逐渐成为生物药领域研发和投资的关注热点。
二、双特异性抗体研发现状
双抗的研究现状
经过Cortellis检索,截至2019年6月15日,双抗处于活跃研发状态的药物有190多个 。其中,已经上市产品3个,临床III期1个,临床II期12个,临床I期有40多个,还有140多个产品处于早期开发阶段。
已上市的3个产品分别是:
Trion公司的Catumaxomab(Removab),靶向EpCAM和CD3,于2009年在欧盟获批用于治疗恶性腹水,成为全球首个获批上市的双特异性抗体。由于商业化不成功,已于2017年6月撤市。
安进的Blinatumomab(Blincyto),靶向CD19和CD3,分别于2014年12月和2015年11月获得美国FDA和欧盟EMA批准上市,用于治疗急性B淋巴细胞白血病。
罗氏的Emicizumab(Hemlibra),靶向凝血因子IX和X,分别于2017年11月和2018年3月获得美国FDA和欧盟EMA批准上市,用于治疗A型血友病,并于2018年12月获NMPA批准在中国上市。
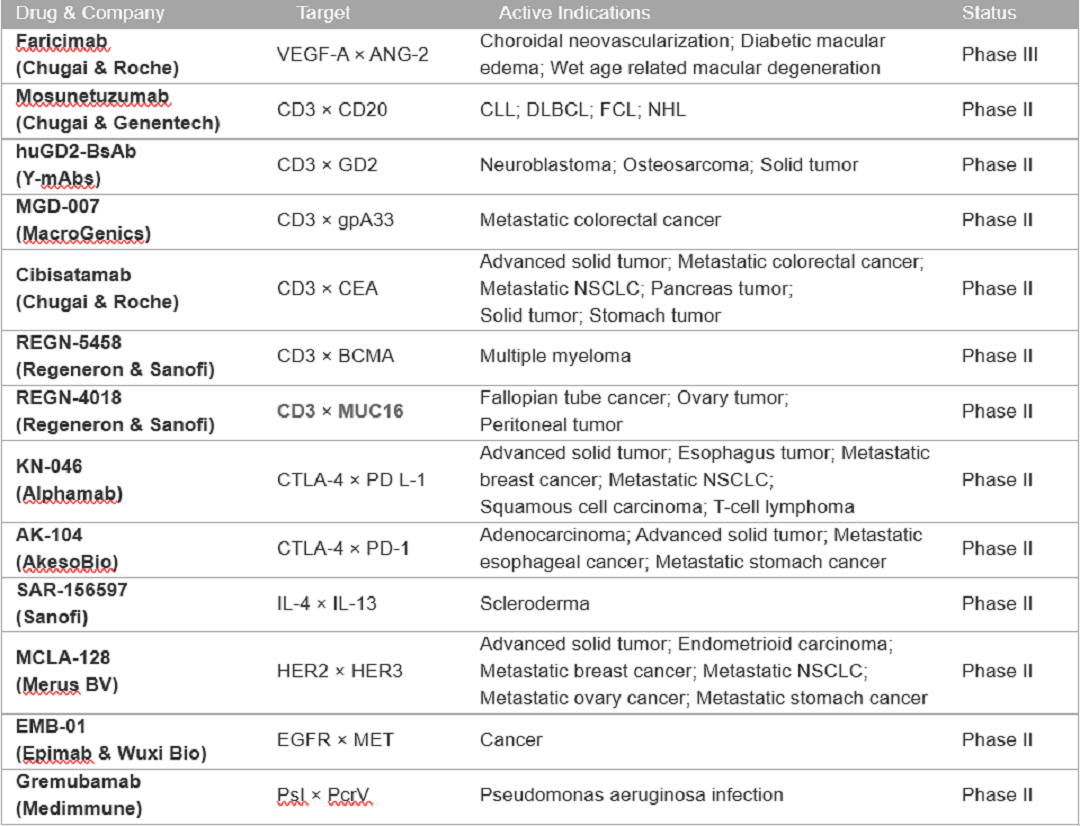
临床III期及临床II期的产品信息
信息根据Cortellis查询结果整理,点击图片可放大,下同
双抗的靶点分布
Blincyto是唯一被批准的针对CD3和CD19的双特异性抗体。目前组合CD3和其他靶点的双抗是研发的主流,已经确定了13种靶点和CD3的组合双抗,最常见的组合为CD3和CD20,其次是CD269和CD33。和CD3组合的特异性双抗已经有6个产品处于临床II期研发。
除了CD3以外,由于肿瘤免疫疗法的研发热潮,针对PD-1的各组合疗法均在如火如荼的进行。其中,CTLA-4作为最早的肿瘤免疫检查点,由于其毒性及有效性使其研发热度远低于PD-1/PD-L1。但是基于CTLA-4与PD-1及其配体因为表达位置不同、在肿瘤免疫中处于不同周期,进而影响不同类型的T细胞,作用机制不重叠,与PD-1/PD-L1具有协同的可能性。目前正在开发三种靶向PD-1和CTLA-4的药物,包括CTLA-4/PD-1双抗(II期1个,I期3个),CTLA-4/PD-L1双抗(II期1个,IND 1个),CTLA-4/PD-1双抗兼CD28融合蛋白(早期研发)。
除此以外,与PD-1/PD-L1靶点相关的双抗开发超过30个,包括与LAG3、TIM3、CD47、BTLA抑制性靶点,及OX40、4-1BB,ICOS、GITR、CD27激活性靶点的组合也在积极研究中。CTLA-4与其他免疫检查点或者抗肿瘤靶点的双抗也在积极研发中,组合靶点包括OX40、CD223、TGFβ、GITR、EGFR等。以上均证明特异性双抗,尤其是和免疫检查点进行组合的双抗是未来抗体治疗肿瘤的热门靶点。
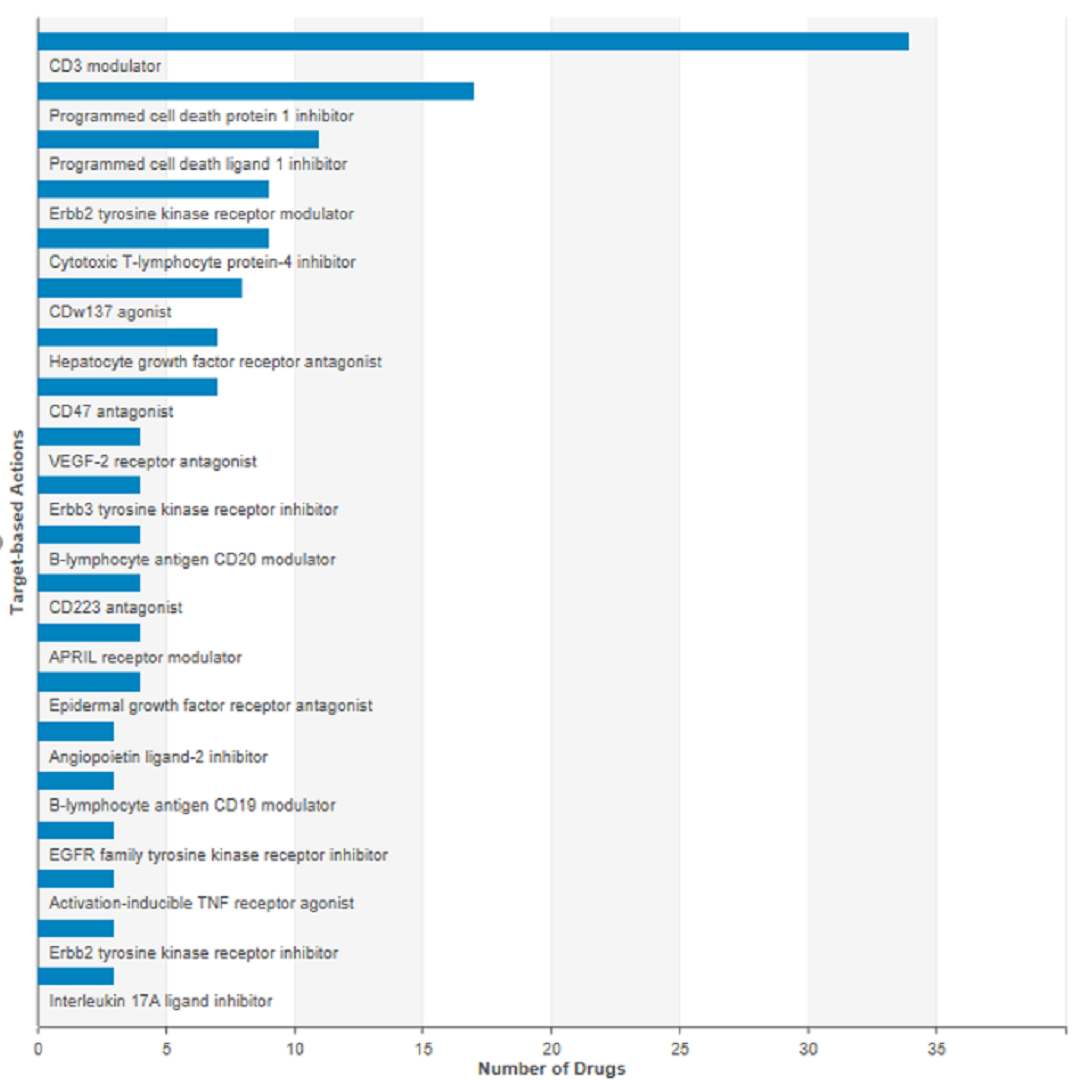
在研双抗的靶点分布情况
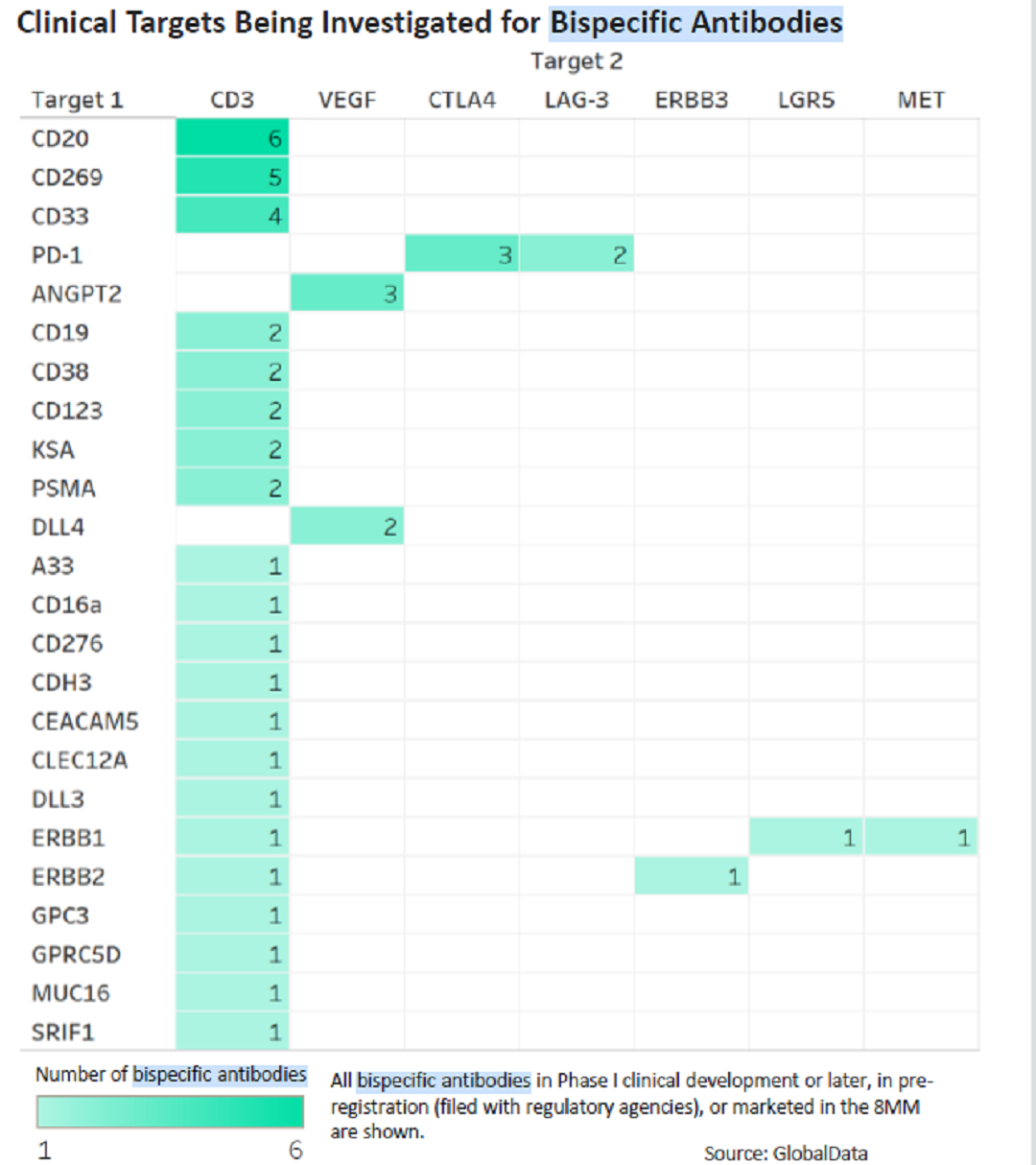
临床阶段双抗的靶点组合
双抗的适应症分布
特异性双抗的研究领域主要集中在肿瘤适应症,另外在抗感染、免疫、血液疾病中也有较为少量的研发。
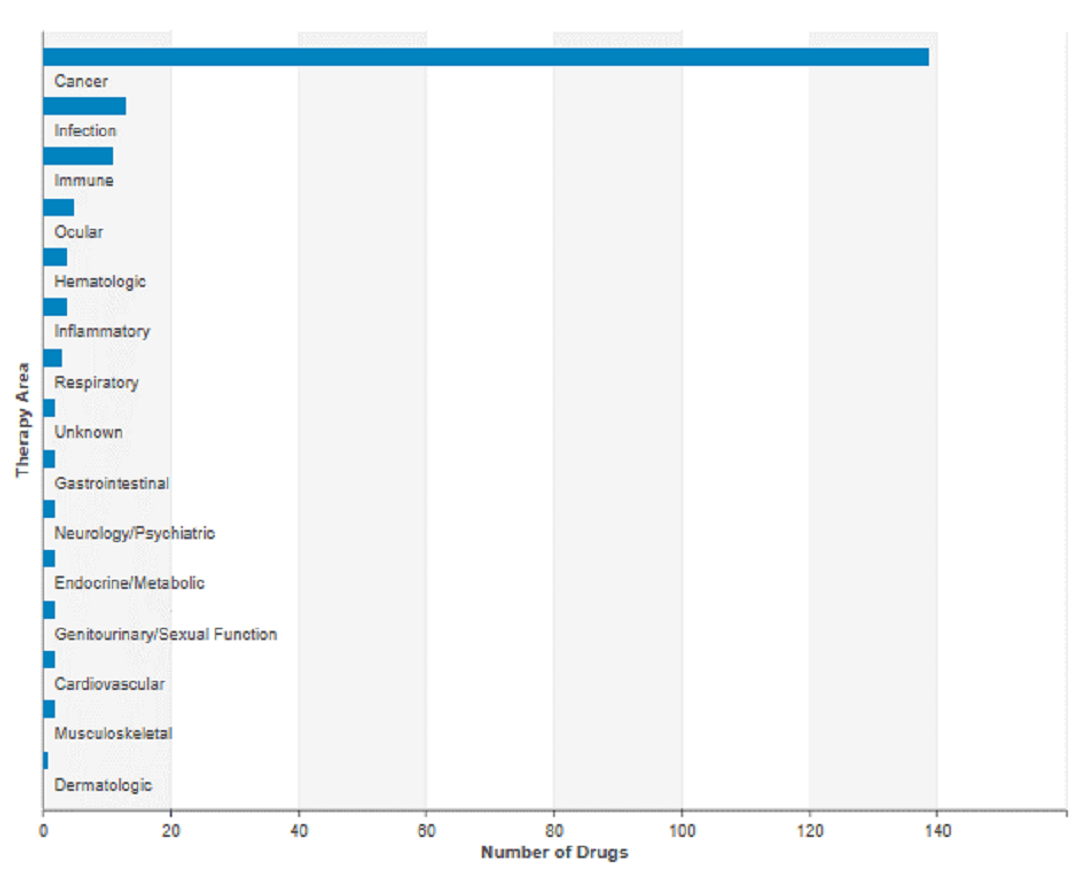
在研双抗的适应症分布
在癌症研究领域中,基于CD3的组合双抗的主要适应症仍然是血液癌(如图4、5所示),其中ALL的临床研究较为晚期,且研发数量居首。但是随着PD-1的组合双抗的研发越来越多,且CD3与其他抗肿瘤靶点的组合也日益增加,相信在未来双抗的适用症范围会不断扩大。
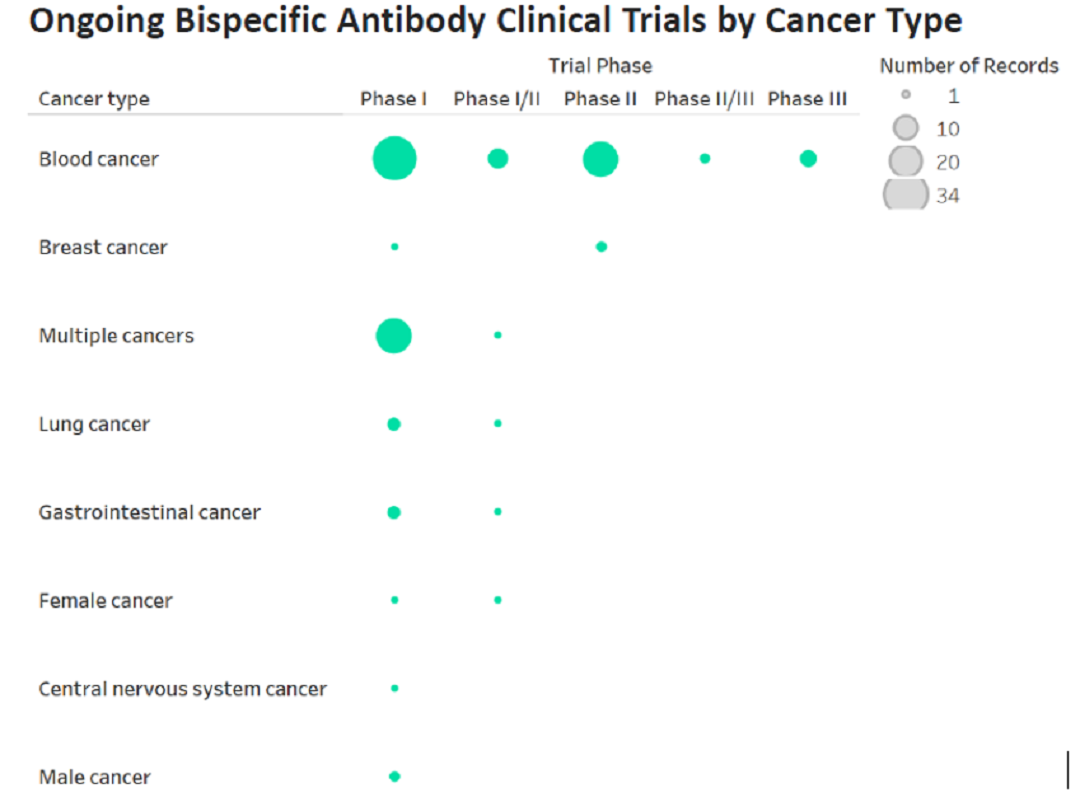 癌症领域双抗的适应症分布
癌症领域双抗的适应症分布
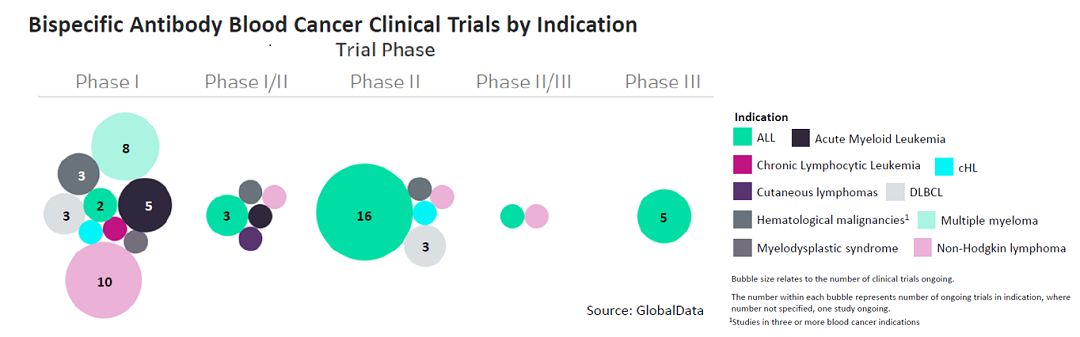
血液癌领域双抗的适应症分布
双抗的未来疗法
以上市的Bilicyto为例,目前的研发模式包括单药研究,联用化学药物研究、联用免疫疗法研究等(如图6所示)。其中,最常见的组合类型是Blincyto + 化疗,表明特异性双抗可以被添加到标准治疗(SOC)中,从而使双抗的未来生命周期更长,使用范围更广。这个研发趋势和肿瘤免疫疗法的PD-1的组合形式也类似,目前,双抗中PD-1的组合众多,相信在未来,化药与PD-1双抗的联用疗法会给肿瘤治疗带来更高的获益。
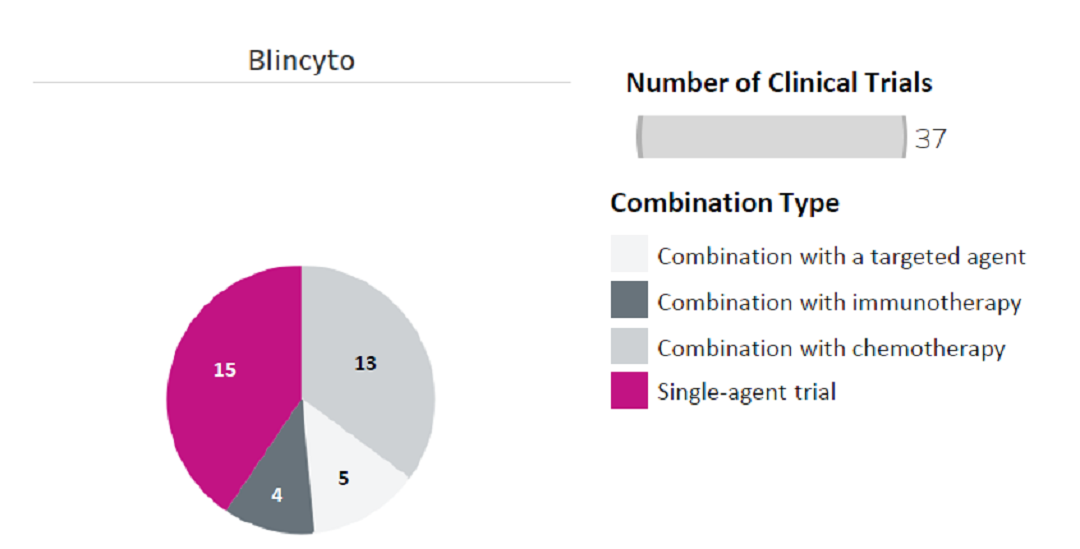 Blincyto临床试验组合类型
Blincyto临床试验组合类型
三、双特异性抗体的技术平台
根据不同结构可将双特异性抗体分为两大类:含Fc片段的双特异性抗体(IgG-like双特异性抗体),代表结构如TrioMab、Crossmab/KIH、DVD-Ig、IgG-scFV、FIT-Ig、mAb-Trap等;与不含Fc片段的双特异性抗体(non-IgG-like双特异性抗体),代表结构如BiTE、DART、TandAb、bi-Nanobody、ImmTAC、TriKE等。
目前,全球范围内在研的双抗技术平台有20多种,不同的分子结构骨架有几十种之多[3,4],在这里不一一列举,主要尝试对比一下目前基于两种不同结构已上市的双抗平台的各自优劣势。
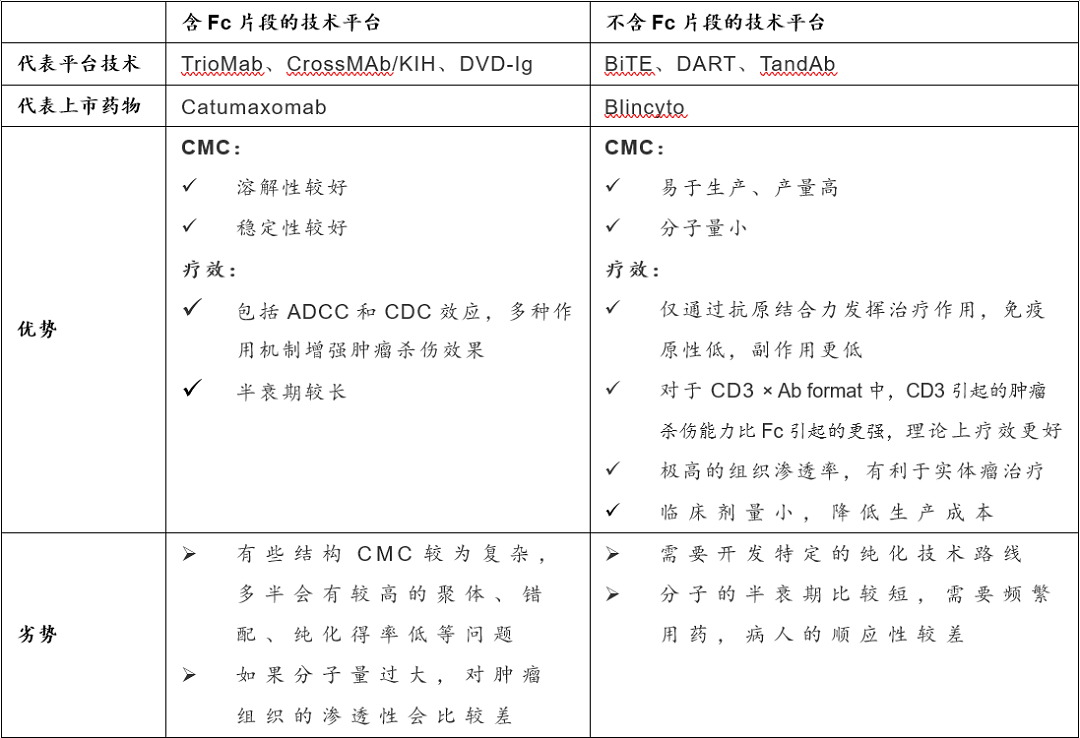 含/不含Fc片段的双抗技术平台一般性特点对比
含/不含Fc片段的双抗技术平台一般性特点对比
实际上,无论哪种技术平台,都各具特色,但仍有不小的改进空间,需要不断地摸索和优化。有意思的是,各自劣势可能也是各自技术平台改进创新的方向。
四、双特异性抗体的发展机遇
抗体类药物是目前市场上最成功的药物,而双特异抗体是抗体药物向功能化发展的重要方向之一,解决单抗不能解决的问题,期望能够增强疗效、扩大适应症范围、突破专利壁垒等。
双抗的发展方向恰恰和双抗的定义相吻合,一是与两种不同的抗原结合,如双抗与肿瘤免疫的结合,CD3等募集免疫细胞,杀灭另一个靶点定位的癌细胞,或者如PD-1/4-1BB和PD-1/CTLA-4等;二是作用于同一抗原的不同表位,如HER2的不同表位。
都说“单抗看靶点,双抗看平台”,当平台技术确定的情况下,归根结底还是要看靶点,如何能够综合平台、靶点、适应症范围综合考量,得到具有差异化技术创新优势的双抗是目前各创新创业公司所要面临的挑战。从技术上来讲,双抗的开发所面临的难点和要点也是丞待解决的主要挑战,包括:
技术平台的建立:是否能够独立开发或者在现有技术平台基础上,作出差异化创新优势并且拥有自主知识产权,开发出兼具成药性、工艺可行性和可放大性的平台技术;能够解决CMC方面所面临的制备、分离、纯化和回收率等问题,以及降低成本和增加生产平台的通用性;
双抗结构的设计:如何平衡和协调两个靶点的安全性和有效性、给药剂量和周期、与不同抗原表位的亲和力等方面问题,比如针对不同的适应症,可能选择的技术平台也不同,再到靶点的选择,是选择免疫/肿瘤,同一个抗原的不同表位,或者是类似于PD-1/4-1BB的“刹车+油门”的方式等;
双抗竞争壁垒:相对于其他治疗技术的不断进展给双抗所带来的竞争性挑战,怎样构建双抗产品的竞争壁垒。特别是对于CAR-T技术的进展,二者的技术原理较为类似,且在血液癌方面都取得了良好效果,都在为实体瘤治疗做改进。
2018年,在圣地亚哥召开的美国血液病学会年上,基于良好的临床疗效,至少在治疗血液癌方面,双抗不输于CAR-T。但是,双抗作为药物使用,比个体化治疗的CAR-T更优越。2019年美国芝加哥的ASCO年上,关于双抗相关的文摘、报告增加了80%,而CAR-T 的则与去年持平,这种现象也是基于这两年双抗在实体瘤领域取得的比较鼓舞人心的临床数据。现在,双抗和CAR-T都在拓展实体瘤治疗领域,但最后还是靠临床数据说话。至少从现在来看,双抗在治疗实体瘤、炎症等领域,进展比CAR-T要快。作为一个新的治疗手段,双抗的作用机制与已成熟的靶向药物不同,而双抗良好的临床前实验数据,并没有在临床上展示出来,说明临床开发确实需要更多的努力和探索。从这个角度而言,一旦临床开发有所突破,双抗应该会有爆发式的发展。期待商业化成功的双抗项目越来越多,给患者的临床治疗提供一种全新的有效选择。
参考文献
1.Spiess C., Zhai Q. & Carter P. J. Alternative molecular formats and therapeutic applications for bispecific antibodies [J]. Mol Immunol. 67, 95-106 (2015).
2.Sergey E Sedykh, Victor V Prinz, Valentina N Buneva, Georgy A Nevinsky. Bispecific antibodies: design, therapy, perspectives [J]. Drug Design, Development and Therapy, 2, 95-208 (2018)
3.Ulrich Brinkmann & Roland E. Kontermann. The making of bispecific antibodies [J], mAbs, 9:2, 182-211 (2017).
4.Aran F. Labrijn, Maarten L. Janmaat, Janice M. Reichert and Paul W. H. I. Parren. Bispecific antibodies: a mechanistic review of the pipeline. Nature Reviews Drug Discovery (2019).
作者简介
.png)
吴彦君
分享投资 投资副总裁
吉林大学医学博士,长江商学院金融MBA在读。
9年医药领域工作经验,曾任职于国内大型制药集团,担任创新药研发部长,所负责的项目有4个进入临床阶段,进展最快的处于临床Ib/II期,专业背景及行业经验丰富;熟练掌握新药研发临床前研究策略,熟悉中国医药市场和政策,对医药企业的战略定位有深入研究。
专注领域:医药。